
Wichtige Faktoren für die klinische Ausprägung
Allergenkonzentration
Die Allergenexposition ist die Voraussetzung für klinische Allergiesymptome bei einem sensibilisierten Patienten. Das Maß der Entzündung, die in den Atemwegen induziert wird, ist jedoch von der Allergenkonzentration und der Dauer der Exposition abhängig. Eine hohe Konzentration eines Allergens löst möglicherweise sofort Symptome aus, während eine geringe Konzentration eine subklinische Entzündung ohne ersichtliche Symptome herbeiführen kann. Diese subklinische Entzündung kann sich jedoch mit der Zeit im Gewebe verstärken und später selbst bei Exposition gegenüber einer sehr geringen Allergenkonzentration zu klinischen Symptomen (dem sogenannten Eisbergphänomen) führen.
Allergenstabilität
Die Stabilität der Allergenmoleküle im Magen-Darm-Trakt ist ein wichtiger Faktor für die klinische Expression von Allergien gegen pflanzliche Nahrungsmittel. Zwischen Allergenkomponenten bestehen große Unterschiede in Bezug auf Stabilität gegenüber Hitze und dem Proteaseverdau, wie er im Magenmilieu erfolgt (siehe Tabelle Seite 8). Stabile Allergene wie nsLTP und Speicherproteine sind auch im Magen-Darm-Trakt noch funktionsfähig und können zu systemischen Reaktionen (Urtikaria, Dyspnoe und Anaphylaxie) führen, während Bet v 1-Homologe und Profiline leicht zersetzt werden und hauptsächlich das orale Allergiesyndrom (OAS) auslösen.
IgE Antikörperkonzentration und Quervernetzung
Die Konzentration von IgE-Antikörpern gegen ein Allergen ist für das Auslösen von klinischen Symptomen entscheidend. Die meisten IgE-Antikörper zirkulieren jedoch nicht im Blutstrom, sondern sind an die Effektorzellen (Mastzellen) im Gewebe gebunden. Es besteht ein Gleichgewicht zwischen freiem und zellgebundenem IgE. Die Konzentration von IgE-Antikörpern in Patientenseren spiegelt folglich die Menge der an die Zelloberfläche von Effektorzellen gebundenen allergenspezifischen IgE-Antikörper wider.
Die Quervernetzung von IgE-Antikörpern an der Zelloberfläche durch Allergene ist eine Voraussetzung für die Zellaktivierung. Die Wahrscheinlichkeit der Zellaktivierung steigt mit der Anzahl der quervernetzten IgE-Moleküle auf der Zelloberfläche. Dies bedeutet, dass sich auf der Allergenkomponente mindestens zwei Epitope befinden müssen, die an zwei verschiedene IgE-Moleküle auf der Zelloberfläche binden können, um eine Aktivierung zu erreichen. Dabei kann es sich um zwei identische (A und C) oder zwei unterschiedliche Epitope (B) auf dem Allergen handeln. Im Fall B sind IgE-Antikörper mit unterschiedlichen Spezifitäten (Polysensibilisierung) erforderlich, um eine Quervernetzung und Zellaktivierung herbeizuführen. Besitzt der Patient nur IgE-Antikörper gegen eines der Epitope, erfolgt keine Quervernetzung, es sei denn, die Epitope kommen repetitiv vor.
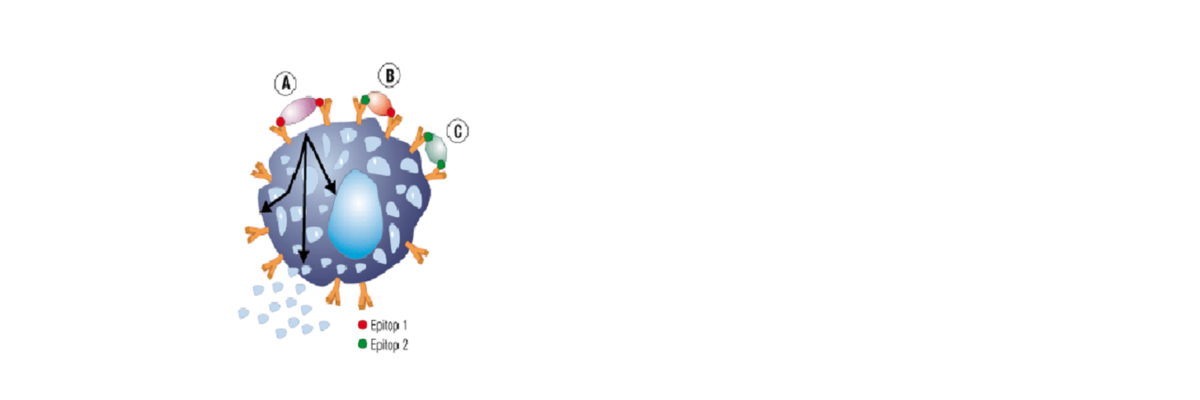
Die Komplexität dieser Quervernetzung von zellgebundenen IgE-Antikörpern könnte die unten beschriebene Kontroverse über die klinische Aussagekraft von IgE-Antikörpern gegen einige Allergene erklären (siehe Abschnitt „CCD-assoziierte Allergie gegen pflanzliche Nahrungsmittel“).
Polysensibilisierung und Multi-Allergenexposition
Wie bereits erwähnt, stehen Zellaktivierung und Entzündung mit dem Maß der Quervernetzung von oberflächengebundenem IgE in Zusammenhang. Darüber hinaus ist bekannt, dass das Risiko der Entwicklung von Asthmasymptomen abhängig ist von der Anzahl der IgE-Antikörperspezifitäten im Sensibilisierungsprofil des allergischen Patienten. Außerdem besitzt ein polysensibilisierter Patient ein erhöhtes Risiko einer Effektorzellenaktivierung, wenn er mehreren Allergenen ausgesetzt ist, weil dabei die Gesamtzahl der quervernetzten IgE-Antikörper auf den Zelloberflächen steigt. Diese Erkenntnisse machen deutlich, dass das Sensibilisierungsprofil (unterschiedliche IgE-Antikörperspezifitäten) eines Patienten in Bezug auf die tatsächliche Allergenexposition unbedingt zu berücksichtigen ist.
Jede einzelne IgE-Antikörperspezifität trägt additiv zum Zellaktivierungsprozess bei, wenn das betreffende Allergen präsent ist.
IgE-Antikörperspezifitäten
Es ist wichtig zu wissen, dass die Konzentration von allergenspezifischem IgE, die mittels Extrakt-basierter Tests gemessen wurde, die Summe der IgE-Antikörper gegen verschiedene Allergenkomponenten in den Extrakten darstellt und deshalb aus unterschiedlichen Spezifitäten besteht. Die Unterschiede bei den Spezifitätenprofilen hängen von der individuellen Sensitivität der Patienten, aber auch vom Allergentyp der Erstsensibilisierung ab. Um mehr Informationen zu erlangen, ist es besonders bei der Nahrungsmittel-Allergie äußerst hilfreich, die einzelnen Allergenspezifitäten der verschiedenen IgE-Antikörper zu analysieren. Denn einige Komponenten
Denn einige Komponenten
- sind weitverbreitet und möglicherweise an einer IgE-Antikörperkreuzreaktivität beteiligt und sollten daher bekannt sein, weisen eine hohe molekulare Stabilität gegenüber Hitze und Proteasen auf, bleiben dadurch im Magen-Darm-Trakt immunogen und können Anaphylaxie auslösen (z. B. nsLTP und Speicherproteine),
- werden im Magenmilieu von Proteasen leicht zerstört, weshalb sie nur im Mund immunogen sind und das orale Allergiesyndrom (OAS) verursachen (z. B. Bet v 1-Homologe und Profiline),
- werden durch Hitze leicht zerstört und sind daher im gekochten Zustand nicht mehr immunogen (z. B. Bet v 1-Homologe und Profiline),
- sind monovalent in Bezug auf die IgE-Antwort des Patienten (nur eine Bindungsstelle für IgE) und können deshalb keine Effektorzellen durch Quervernetzung von IgE-Rezeptoren aktivieren (z. B. einige CCD-haltige Allergene).